Método y análisis de prueba de esterilidad comercial de alimentos
Fecha y hora de publicación: 2020-09-08, 16:12
Fecha y hora de modificación: 2021-05-02, 10:18
Autor: Food-Men
Las pruebas de esterilidad comercial son imprescindibles para alimento de latas, botellas de vidrio y envases blandos enlatados. Este artículo presenta método de prueba de esterilidad comercial de alimentos y análisis de causas anormales para cumplir con requisitos de FDA.
1. Descripción de algunos términos
1.1 Esterilidad comercial
La esterilidad comercial significa que no hay bacterias y toxinas patógenas que pongan en peligro la salud pública; no contiene ningún microorganismo que pueda propagarse durante el almacenamiento, transporte y venta del producto; mantiene una calidad estable y un buen valor comercial durante la vida útil del producto.
1.2 Alimentos enlatados bajos en ácido
Además de las bebidas alcohólicas, los alimentos enlatados con un pH equilibrado superior a 4,6 y una actividad de agua superior a 0,85. Por ejemplo: frutas, vegetales o productos de baja acidez. Los que agregan ácido para bajar el pH con el propósito de esterilizar con calor son los alimentos enlatados acidificados con bajo contenido de ácido.
1.3 Alimentos enlatados ácido
Los alimentos enlatados ácidos se refieren a los alimentos enlatados con un pH de equilibrio de 4.6 o menos después de la esterilización. Por ejemplo: tomates, peras, piñas y jugos hechos con un pH inferior a 4,6.
1.4 Tipo de envase de lata
Los tipos de envases de latas incluyen principalmente latas de metal (latas, latas de aluminio), latas de vidrio (botellas), latas de plástico (envases de varias formas) y envases de materiales compuestos.
2. Proceso de inspección de esterilidad comercial
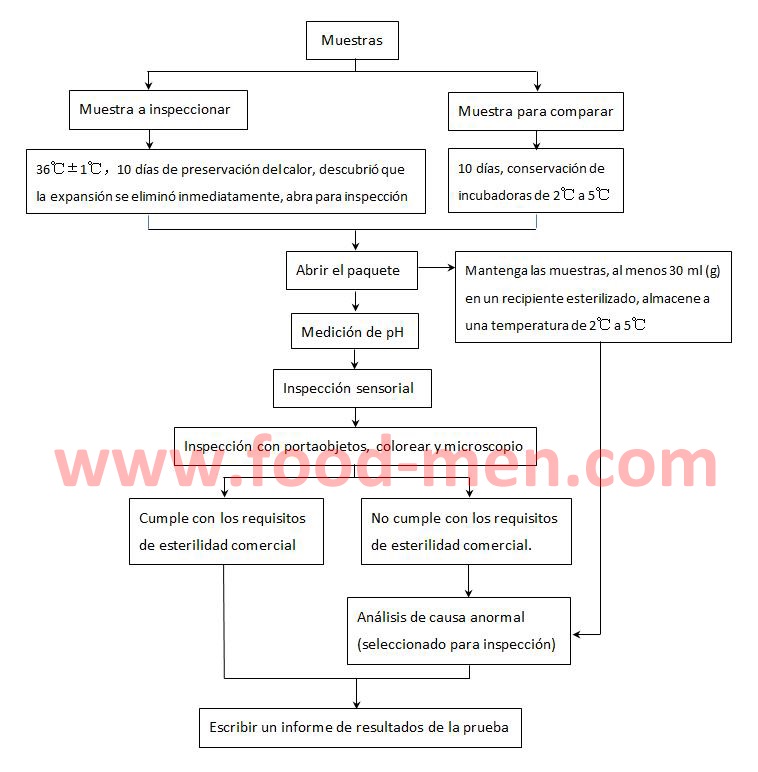
3. Instrucciones de operación para la prueba de esterilidad comercial
(Haga clic en la fuente azul para navegar en otra página y ver la introducción relevante)
3.1 Todas las herramientas que entren en contacto con el contenido de la muestra deben esterilizarse con Esterilizadores de autoclave de laboratorio horizontales o Esterilizadores de autoclave de laboratorio verticales.
3.2 La operación de la muestra abrir o después de abrir la tapa se llevará a cabo en un ambiente limpio de aire, es decir, una operación aséptica. La operación aséptica se puede realizar en un laboratorio estéril (sala limpia) o en bancos limpios.
3.3 Si el contenido es una mezcla de sólidos y líquidos, colóquelos en las Bolsas de homogeneizar de muestra estériles, selle la bolsa, golpee con homogeneizadores estériles, rompe los sólidos de los contenidos y luego inspeccione.
3.4 Si el contenido es de múltiples líquidos y desea agitar de manera uniforme, use un Mezclador de agitador magnético con temporizador y placa calefactora, o use un Mezclador de agitador magnético de 4 cabezales con placa calefactora, o use Incubadoras multifuncionales de agitador orbital de bandeja para laboratorio, para asegurarse de que no haya microorganismos contaminantes al agitar.
3.5 La inspección sensorial se refiere a observar el color y la morfología del tejido del contenido de la muestra, y sentir su olor.
3.6 Cuando se descubre que la muestra es inconsistente con los requisitos de esterilidad comercial, es necesario analizar la causa de la anormalidad y, si es necesario, un cultivo especial y la detección de la bacteria para descubrir la causa.
3.7 Se requiere una prueba en blanco (prueba de muestra que no hay microbiológica). Cuando la prueba en blanco también tiene microorganismos, indica que hay un problema con la operación de prueba y el resultado no es creíble.
4. Análisis de causa anormal para prueba de esterilidad comercial
4.1 Si no se encuentran microorganismos en la muestra expandida, esta expansión puede deberse a una reacción química entre el contenido y el recipiente. Por ejemplo, los alimentos ácidos se corroen con metales en recipientes metálicos y producen gases. Además, el sobrellenado del contenido también puede provocar una ligera expansión.
4.2 El examen microscópico revela una gran cantidad de bacterias, pero no crece después del cultivo, que puede ser el cadáver de las bacterias, que puede ser la corrupción que ocurre antes de la esterilización.
4.3 El contenedor de empaque es "buen sellado", y hay microbios que no son resistentes al calor en condiciones de cultivo de 36℃ (como la levadura), puede haber fugas del contenedor o no hay esterilización durante el proceso de producción.
4.4 El contenedor de empaque tiene un buen rendimiento de sellado, solo bacillus crece bajo la condición de cultivo a 36℃, y su resistencia al calor no es mayor que Clostridium botulinum, lo que indica una esterilización insuficiente.
4.5 Algunas bacterias anaeróbicas no producen gas, no hay expansión del contenedor de empaque, no hay fugas, solo la superficie del contenedor es difícil de encontrar las bacterias del contenido, pero se detecta el pH del contenido, el producto se vuelve ácido (acidificado). Los contenidos se inocularon en medio de caldo de glucosa púrpura bromocresol (tubo de ensayo); se cultivaron a 36℃ o 55℃, si había bacterias presentes, y se produjo ácido, lo que indica que había un microorganismo mesofílico. Por ejemplo: bacterias agrias planas, Bacillus termofílico y similares. Si aparecen estas bacterias, se debe aumentar la fuerza bactericida de la lata.
Los microorganismos se cultivan en diferentes entornos a través de diferentes medios de cultivo; se observa la morfología, la producción de gas y la producción de ácido de los microorganismos para descubrir los tipos de microorganismos. Esto analizará las causas de la corrupción alimentaria y proporcionará una base para mejorar la producción de alimentos.
5. Métodos de observación de tinción microbiana
5.1 Solución colorante violeta cristal
5.1.1 Composiciones
Violeta cristal: 1,0 g
95 % Etanol: 20,0 ml
1 % solución de oxalato de amonio: 80,0 ml
5.1.2 Método de preparación
Disuelva 1,0 g de Crystal Violet en etanol al 95% y luego mezcle con una solución de oxalato de amonio al 1%.
5.1.3 Método de tinción
Fija la mancha con la llama de un mechero de alcohol. Agregue el violeta cristal al frotis gota a gota y tiñe durante 1 minuto, luego enjuague con agua.
5.2 Solución de tinción de Gram
5.2.1 Solución colorante violeta cristal
5.2.1.1 Composiciones
Violeta cristal: 1,0 g
95 % Etanol: 20,0 ml
1 % solución de oxalato de amonio: 80,0 ml
5.2.1.2 Método de preparación
Disuelva 1.0g de violeta cristal completamente en 95 de etanol y luego mezcle con 1 de solución de oxalato de amonio.
5.2.2 Solución de yodo de Gram
5.2.2.1 Composiciones
Yodo: 1,0 g
Yoduro de potasio: 2,0 g
Agua destilada: 300 ml
5.2.2.2 Método de preparación
Primero, mezcle 1.0 g de yoduro con 2.0 g de yoduro de potasio. Luego agregue un poco de agua destilada a la mezcla y agite bien. Una vez que esté completamente disuelto, agregue agua destilada a 300 ml.
5.2.3 Safranine (contratinción)
5.2.3.1 Composiciones
Safranina: 0,25 g
95 % Etanol: 10,0 ml
Agua destilada: 90,0 ml
5.2.3.2 Método de preparación
Disuelva 0,25 g de safranina en etanol y luego diluya con agua destilada.
5.2.4 Método de tinción
5.2.4.1 Fije una mancha en la llama de un quemador de alcohol. Agregue el violeta cristal al frotis gota a gota y tiñe durante 1 minuto, luego enjuague con agua.
5.2.4.2 Agregue el yodo de gramo gota a gota, retenga por 1 minuto y luego enjuague con agua.
5.2.4.3 Agregue etanol al 95% gota a gota, decolore durante aproximadamente 15 ~ 30 segundos hasta que la solución de tinción se elimine. No se permite decolorar demasiado y luego enjuagar con agua.
5.2.4.4 Agregue el líquido de contratinción gota a gota, vuelva a teñir durante 1 minuto y enjuague con agua. Realizar microscopía después del secado.
6. Preparación de medio de cultivo y solución nutritiva
6.1 Caldo de dextrosa púrpura de bromcresol
6.1.1 Composiciones
Peptona: 10,0 g
Extracto de ternera: 3,0 g
Glucosa: 10,0 g
Cloruro de sodio: 5,0 g
Bromocresol Purple: 0.04g (o 1.6 1.6 de solución de etanol, 2.0 ml)
Agua destilada: 1000,0 ml
6.1.2 Método de preparación
Calentar, mezclar y disolver todas las composiciones excepto Bromocresol Purple. Ajuste el pH a 7,0 ± 0,2 y luego agregue Bromocresol Purple a la solución mezclada. Dispensarlo en tubos de ensayo con pequeños tubos de ensayo invertidos. Y cada tubo debe rellenarse con 10 ml de la solución mezclada y esterilizarse en autoclave a 121℃ durante 10 minutos.
6.2 Carne cocida mediana
6.2.1 Composiciones
Caldo de infusión de ternera: 1000,0 ml
Peptona: 30,0 g
Extracto de levadura: 5,0 g
Glucosa: 3,0 g
Dihidrogenofosfato de sodio: 5,0 g
Almidón soluble: 2,0 g
Residuos de carne: cantidad adecuada
6.2.2 Método de preparación
6.2.2.1 Pese 500 g de carne fresca picada sin grasa ni fascia, luego mezcle con 1000 ml de agua destilada y 25,0 ml de solución de hidróxido de sodio 1 mol / l. Revuelva la solución, hiérvala durante 15 minutos y déjela enfriar. Retirar la grasa externa, aclarar y filtrar la solución. Agregue 1000 ml de agua para obtener el caldo de infusión de carne. Agregue todas las composiciones excepto los residuos de carne mencionados en 6.2.1 y luego ajuste el valor de pH a 7.8 ± 0.2.
6.2.2.2 Lavar el residuo de la carne con agua y dejarlo medio seco. Llénelo respetuosamente en tubos de ensayo (15 mm × 150 mm), que mide entre 2 cm y 3 cm de alto. Añada 0,1 ga 0,2 g de polvo de hierro reducido o algunas limaduras de hierro en cada tubo de ensayo. Llene cada tubo de ensayo con el medio de cultivo líquido preparado de 6.2.2.1, haciendo que el líquido sea aproximadamente 1 cm más alto que la superficie de los residuos de carne. Luego se cubre con vaselina disuelta o parafina líquida (de 0,3 cm a 0,4 cm de altura). Autoclave a 121 ℃ durante 15 minutos.
6.3 Agar nutritivo
6.3.1 Composiciones
Peptona: 10,0 g
Extracto de ternera: 3,0 g
Cloruro de sodio: 5,0 g
Agar: 15.0 a 20.0 g
Agua destilada: 1000,0 ml
6.3.2 Método de preparación
Disuelva todas las composiciones excepto el agar en agua destilada y luego agregue aproximadamente 2 ml de solución de hidróxido de sodio al 15%. Ajuste el pH de 7,2 a 7,4. Luego agregue agar y caliente a ebullición para disolver el agar. Dispense la solución obtenida en matraces o tubos de ensayo (13 mm × 130 mm) respectivamente. Autoclave a 121 ℃ durante 15 minutos.
6.4 Caldo ácido
6.4.1 Composiciones
Polipetono: 5.0g
Extracto de levadura: 5,0 g
Glucosa: 5,0 g
Dihidrogenofosfato de potasio: 5,0 g
Agua destilada: 1000,0 ml
6.4.2 Método de preparación
Calentar, remover y disolver todas las composiciones mencionadas en 6.4.1. Ajuste el pH a 5,0 ± 0,2. Autoclave a 121℃ durante 15 minutos.
6.5 Caldo de extracto de malta
6.5.1 Composiciones
Extracto de malta: 15,0 g
Agua destilada: 1000,0 ml
6.5.2 Método de preparación
Disuelva el extracto de malta completamente en agua destilada, luego filtre con papel de filtro. Ajustar el pH a 4,7 ± 0,2 y distribuirlo en varios recipientes. Autoclave a 121℃ durante 15 minutos.
6.6 Agar dextrosa de Sabouraud
6.6.1 Composiciones
Peptona: 10,0 g
Agar: 15,0 g
Glucosa: 40,0 g
Agua destilada: 1000,0 ml
6.6.2 Método de preparación
Disolver todas las composiciones en agua destilada y calentar a ebullición. Ajuste el pH a 5,6 ± 0,2. Autoclave a 121℃ durante 15 minutos.
6.7 Agar hígado de ternera
6.7.1 Composiciones
Extracto de hígado: 50,0 g
Extracto de ternera: 500,0g
Peptona proteosa: 20,0 g
Neopeptona: 1,3 g
Triptona: 1,3 g
Glucosa: 5,0 g
Almidón soluble: 10,0 g
Caseína de plasma: 2,0 g
Cloruro de sodio: 5,0 g
Nitrato de sodio: 2,0 g
Gelatina: 20,0 g
Agar: 15,0 g
Agua destilada: 1000,0 ml
6.7.2 Método de preparación
Disuelva todas las composiciones en agua destilada. Ajuste el pH a 7,3 ± 0,2. Autoclave a 121℃ durante 15 minutos.
Nota
La mayoría de los países tienen disposiciones para la prueba de esterilidad comercial de los alimentos, pero las regulaciones para cada país pueden variar. Este artículo se refiere principalmente a las especificaciones de prueba de esterilidad comercial relevantes de la República Popular de China.
——————————————————————
Artículos relacionados
1. Equipos y pruebas de esterilidad comercial de alimentos
2. Equipos para cuenta de placa aeróbica
3. Equipos de prueba y cuenta de coliformes
4. Principio de conservación enlatada (1) - Conocimiento general
5. Principio de conservación enlatada (2) - tamaños de latas
6. Principio de conservación enlatada (3) - soldadura de resistencia de lata de 3 piezas
7. Principio de conservación enlatada (4) - sello de doble cierre de latas
8. Principio de conservación enlatada (5) - La generación de vacío en la lata
9. Principio de conservación enlatada (6) - Esterilización de conservas
10. Método del tratamiento y purificación automáticos para agua potable
—————————————————————— 