Método de prueba y cuenta de bacterias coliformes
Fecha y hora de publicación: 2020-9-29, 08:32
Fecha y hora de modificación: 2021-05-07, 19:50
Autor: Food-Men
Este artículo presenta los métodos para la prueba y cuenta de bacterias coliformes en los alimentos. El método de cuenta de MPN es adecuado para contar con menor contenido de coliformes, y el método de cuenta de medios de placa es adecuado para contar con mayor contenido. Se utilizan los instrumentos de inspección microbiológica comúnmente utilizado.
Principios de los métodos de prueba y cuenta de bacterias coliformes
Las bacterias coliformes se encuentran comúnmente en las heces de los animales de sangre caliente, incluidos los humanos. Al probar y contar las bacterias coliformes, puede determinar el grado de contaminación de los alimentos con bacterias. El coliforme individuale es generalmente difíciles de ver a simple vista, pero después de ser criados, crecen de una sola bacteria a una flora, que se puede ver y contar fácilmente. El número total de bacterias coliformes puede mostrar el estado de higiene de los alimentos en general, por lo tanto, muchos países tienen regulaciones estrictas sobre el número total de bacterias coliformes en los alimentos. Además, las bacterias coliformes pueden fermentar la lactosa y generar ácidos y gases cuando se incuban a 35–37 °C. El uso de esta función puede analizar la cantidad de bacterias coliformes en los alimentos. Hay dos formas de contar los coliformes aquí:
1. Método de cuenta de MPN para coliformes
1.1 Pasos de operación para la cuenta MPN de coliformes
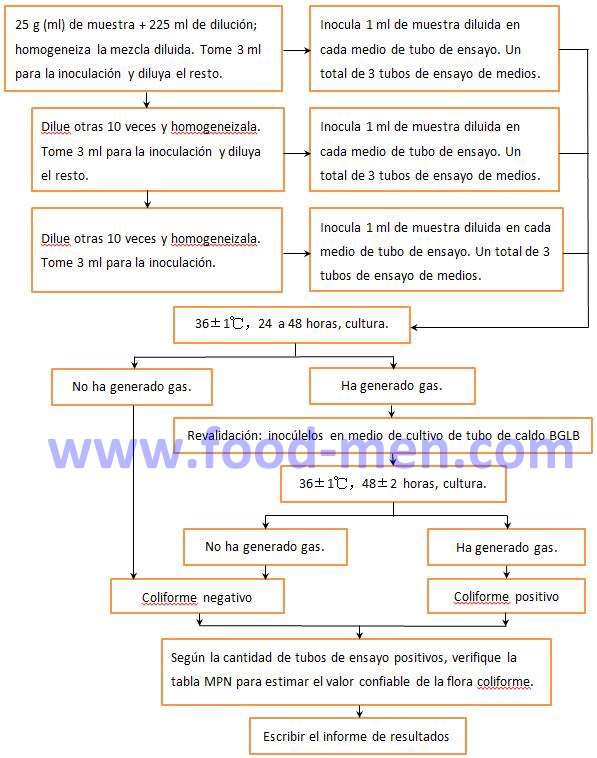 1.2 Instrucción de operación para la cuenta MPN de coliformes
1.2 Instrucción de operación para la cuenta MPN de coliformes
Si hay bacterias presentes en el medio pero no se genera gas, la flora coliforme es negativa. Sin embargo, se necesitan más análisis para determinar si los tipos de estas bacterias son perjudiciales para el cuerpo humano. Descubra qué causó estas bacterias.
2. Método de cuenta de medios de placa para coliformes
2.1 Pasos de operación para la cuenta de placas de coliformes
 2.2 Instrucción de operación para la cuenta de placas de coliformes
2.2 Instrucción de operación para la cuenta de placas de coliformes
• Si hay colonias en el medio de la placa, pero la verificación posterior no genera gas. Aunque es negativo para la flora coliforme, se necesitan más análisis y pruebas para determinar si el tipo de bacteria es perjudicial para el cuerpo humano.
• Cálculo de bacterias coliformes: N = A × (C / B) × T
De los cuales:
N ---- El número de bacterias coliformes.
A ---- El número de colonias en el medio de la placa. Cuente con un contador automático de colonias o manual.
B ---- Lo número que recogen las colonias del medio de cultivo en placa y se inoculan en medio de tubo de ensayo de caldo BGLB, cuando se vuelve a verificar. Generalmente 10 o menos. Utilice un asa de inoculación o una aguja de inoculación para recoger las colonias e inocúlelas.
C ---- El número de medio de cultivo de tubo de ensayo de caldo BGLB que genera gas durante la reverificación.
T ---- múltiplos de dilución de muestra
3. Precauciones para la operación de los métodos de prueba y cuenta de coliformes
(Haga clic en la fuente azul para navegar en otra página y ver la introducción relevante)
3.1 Todas las herramientas que entren en contacto con el contenido de la muestra deben esterilizarse con Esterilizadores de autoclave de laboratorio horizontales o Esterilizadores de autoclave de laboratorio verticales.
3.2 La operación de la muestra abrir o después de abrir la tapa se llevará a cabo en un ambiente limpio de aire, es decir, una operación aséptica. La operación aséptica se puede realizar en un laboratorio estéril (sala limpia) o en bancos limpios.
3.3 Si el contenido es una mezcla de sólidos y líquidos, colóquelos en las Bolsas de homogeneizar de muestra estériles, selle la bolsa, golpee con homogeneizadores estériles, rompe los sólidos de los contenidos y luego inspeccione.
3.4 Si el contenido es de múltiples líquidos y desea agitar de manera uniforme, use un Mezclador de agitador magnético con temporizador y placa calefactora, o use un Mezclador de agitador magnético de 4 cabezales con placa calefactora, o use Incubadoras multifuncionales de agitador orbital de bandeja para laboratorio, para asegurarse de que no haya microorganismos contaminantes al agitar.
3.5 Se requiere una prueba en blanco (prueba de muestra que no hay microbiológica). Cuando la prueba en blanco también tiene microorganismos, indica que hay un problema con la operación de prueba y el resultado no es creíble.
4. Preparación del medio de cultivo para la prueba de coliformes
4.1 Caldo de triptosa de sulfato de laurilo (LST)
4.1.1 Composición
Typtone o Trypticase: 20,0 g
Cloruro de sodio: 5,0 g
Lactosa: 5,0 g
Fosfato de hidrógeno de potasio (K2HPO4): 2,75 g
Dihidrogenofosfato de potasio (KH2PO4): 2,75 g
Lauril sulfato de sodio: 0,1 g
Agua destilada: 1000 ml
4.1.2 Método de preparación
Disuelva todos los componentes anteriores en agua destilada y ajuste el pH a 6,8 ± 0,2. Dispense 10 ml de la solución en cada tubo de ensayo que tenga pequeños tubos de vidrio al revés y esterilice durante 15 minutos en la autoclave a 121℃.
4.2 Caldo de bilis lactosa verde brillante (BGLB)
4.2.1 Composición
Peptona: 10,0 g
Lactosa: 10.0g
Solución Oxgall u Oxbile: 200.0 ml
Solución de agua verde brillante al 0,1%: 13,3 ml
Agua destilada: 800 ml
4.2.2 Método de preparación
Disuelva peptona y lactosa en aproximadamente 500 ml de agua destilada, agregue 200 ml de solución oxgall (disuelva 20.0 g de polvo oxgall deshidratado en 200 ml de agua destilada y ajuste el pH a 7.0 ~ 7.5), diluya a 975 ml con agua destilada, ajuste el pH a 7,2 ± 0,1 y luego agregue 13,3 ml de solución de agua verde brillante al 0,1%, diluya a 1000 ml con agua destilada, filtre la solución a través de algodón y luego dispense 10 ml de la solución en cada tubo de ensayo que tenga pequeños tubos de vidrio hacia atrás. Esterilizar durante 15 minutos en la autoclave a 121℃.
4.3 Agar biliar rojo violeta (VRBA)
4.3.1 Composición
Peptona: 7,0 g
Extracto de levadura: 3,0 g
Lactosa: 10,0 g
Cloruro de sodio: 5,0 g
Sal biliar o sal biliar n. ° 3: 1,5 g
Rojo neutro: 0.03g
Violeta cristal: 0,002g
Agar: 15 g ~ 18 g
Agua destilada: 1000 ml
4.3.2 Método de preparación
Disuelva todos los componentes anteriores en agua destilada, deje reposar durante unos minutos, revuelva completamente y ajuste el pH a 7,4 ± 0,1. Hervir durante 2 min, derretir y mantener la temperatura del medio de cultivo dentro del rango de 45℃ ~ 50℃ y verter en la placa. Prepárelo inmediatamente antes de usar, dentro de las 3 horas.
5. Nota
En la mayoría de los países, existen regulaciones claras sobre los métodos para la prueba y cuenta de coliformes, pero las regulaciones pueden diferir de un país a otro. Este artículo se refiere principalmente a las especificaciones de pruebas relevantes de la República Popular de China y es solo para referencia.
——————————————————————
Artículos relacionados
1. Equipos y pruebas de esterilidad comercial de alimentos
2. Equipos para cuenta de placa aeróbica
3. Equipos de prueba y cuenta de coliformes
4. Principio de conservación enlatada (1) - Conocimiento general
5. Principio de conservación enlatada (2) - tamaños de latas
6. Principio de conservación enlatada (3) - soldadura de resistencia de lata de 3 piezas
7. Principio de conservación enlatada (4) - sello de doble cierre de latas
8. Principio de conservación enlatada (5) - La generación de vacío en la lata
9. Principio de conservación enlatada (6) - Esterilización de conservas
10. Método del tratamiento y purificación automáticos para agua potable
—————————————————————— 
